Ikkalasi ham kimyoviy birikmalar kimyoviy elementlar molekulalardan iborat bo'lib, ular o'z navbatida atomlardan iborat. Atomlar deb atalmish shakllanishi tufayli birlashgan bo'lib qoladi kimyoviy aloqalar.
The kimyoviy bog'lanishlarning barchasi bir xil emas: asosan, ular atomlarning elektron xususiyatlariga bog'liq. Havolaning eng keng tarqalgan ikkita turi mavjud: ionli bog'lanishlar va kovalent bog'lanishlar
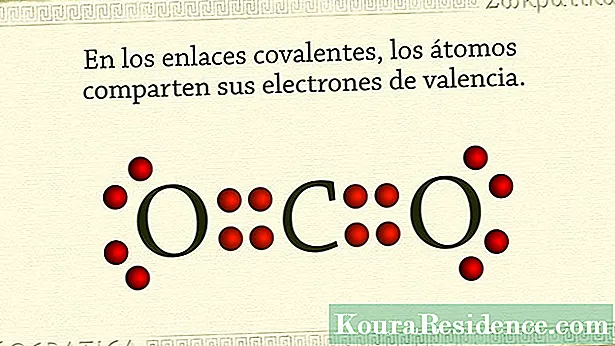
Odatda, kovalent bog'lanishlar shundaydir metall bo'lmagan atomlarni ushlab turing. Bu elementlarning atomlari tashqi qobig'ida juda ko'p elektronlarga ega va elektronlardan voz kechish o'rniga ularni ushlab qolish yoki to'plash tendentsiyasiga ega.
Shuning uchun ham ushbu moddalar yoki kimyoviy birikmalarning usuliikos barqarorlikka erishish bir juft elektronni bo'lishish orqali bo'ladi, uhar bir atomdan emas. Shu tarzda, umumiy elektronlar juftligi ikki atom uchun odatiy va shu bilan birga ularni ushlab turadi. In gazlar masalan, zodagonlar, bu sodir bo'ladi. Shuningdek, halogen elementlarda.
Kovalent boglanish xuddi shunday elektromanfiylik elementlari orasida, vodorod va uglerod orasidagi singari bog lanish hosil bo ladi apolar kovalent. Bu, masalan, uglevodorodlarda sodir bo'ladi.
Xuddi shunday, gomonukleer molekulalari (bir xil atomdan tashkil topgan) doimo hosil bo'ladi apolar bog'lanishlar. Ammo agar bog'lanish turli xil elektr manfiyligi elementlari o'rtasida yuzaga kelsa, bitta atomda boshqasiga qaraganda yuqori elektron zichligi hosil bo'ladi, buning natijasida qutb hosil bo'ladi.
Uchinchi imkoniyat - ikkita atom bir juft elektronni bo'lishishi, ammo bu umumiy elektronlarga ularning atomi faqat bitta ta'sir qiladi. Bunday holda biz gaplashamiz kovalent bog'laydigan yoki koordinatali bog'lanish.
Uchun dative link Sizga erkin elektron jufti (azot kabi) va ikkinchisi elektron etishmaydigan (vodorod kabi) element kerak. Bundan tashqari, elektron juftlikka ega bo'lgan kishi, elektronni bo'lishish uchun elektronni yo'qotmaslik uchun etarli darajada salbiy ta'sir ko'rsatishi kerak. Bunday holat, masalan, ammoniyda (NH4) sodir bo'ladi+).
The moddalar tarkibida kovalent birikmalar moddalarning har qanday holatida (qattiq, suyuq yoki gazsimon) va umuman olganda paydo bo'lishi mumkin ular issiqlik va elektr energiyasining yomon o'tkazgichlari.
Ular ko'pincha ko'rsatadilar nisbatan past erish va qaynash nuqtalari Y odatda qutbli erituvchilarda eriydi, benzol yoki tetraklorid kabi, ammo ularning suvda eruvchanligi yomon. Ular juda barqaror.
Kovalent bog'lanishni o'z ichiga olgan aralashmalar yoki moddalarga ko'plab misollar keltirish mumkin:
- Ftor
- Brom
- Yod
- Xlor
- Kislorod
- Suv
- Karbonat angidrid
- Ammiak
- Metan
- Propan
- Silika
- Olmos
- Grafit
- Kvarts
- Glyukoza
- Parafin
- Dizel
- Azot
- Geliy
- Freon